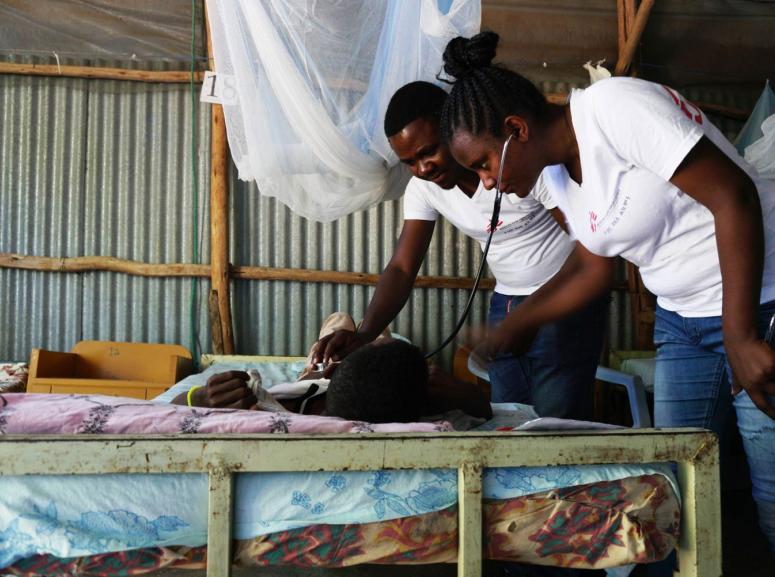
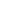Leishmaniose viscérale
Kala-azar, une maladie parasitaire négligée
Il existe 3 formes principales de leishmaniose :
- La forme cutanée, la plus fréquente, se caractérise par des lésions ulcéreuses,
- la forme cutanéo-muqueuse, avec des ulcérations au niveau de la bouche, du nez et de la gorge apparaissent et la leishmaniose viscérale souvent appelée kala-azar qui signifie mal noir est la plus sévère.
- La leishmaniose viscérale (LV) se manifeste par de la fièvre, de la fatigue, une hypertrophie du foie et de la rate, une perte de poids et de l'anémie. La leishmaniose viscérale est due à des protozoaires du genre Leishmania transmis par la piqûre de phlébotomes, un insecte piqueur de quelques millimètres répandu dans les régions semi-arides. Sans traitement, l’issu de la leishmaniose viscérale est fatal.
Environ 50 000 à 90 000 nouveaux cas de leishmaniose viscérale apparaissent chaque année et la majeure partie survient dans au Brésil, en Afrique de l’Est et en Inde.1 Les épidémies de leishmaniose viscérale touchent les populations les plus pauvres, vivant dans des conditions le plus souvent insalubres. Elles sont favorisées par l’émergence de résistance aux médicaments, par les déficits immunologiques liées à la malnutrition et au VIH, et par les déplacements de population.
Le diagnostic de la leishmaniose viscérale repose sur une évaluation sérologique et la parasitologie (tests rapides et biopsies de la rate, de la moelle osseuse et des ganglions). Si le système immunitaire parvient à combattre l’infection, la personne est alors immunisée contre toute nouvelle attaque. Sinon elle tombe malade et le parasite se propage alors dans la moelle osseuse, la rate, le foie et les ganglions. La leishmaniose viscérale s’accompagne d’un noircissement de la peau d’où son nom de mal noir ou kala-azar.
Le traitement de la leishmaniose viscérale varie selon l'hôte et les facteurs parasitaires, mais aussi les régions. Les traitements ne permettant pas d'éliminer le parasite de l'organisme, des rechutes surviennent. Sans traitement, la LV est habituellement mortelle. Tout retard dans le dépistage et le traitement augmentent le risque de morbidité et de mortalité ainsi que la propagation de la maladie à d'autres personnes.
Comme la leishmaniose viscérale se développe au détriment du système immunitaire, les personnes vivant avec le VIH ayant un système immunitaires défaillant sont donc plus à risque de développer des formes sévères de la maladie. Malheureusement c’est l’une des maladies opportunistes du sida les plus difficile à traiter.
Par ailleurs la leishmaniose viscérale affaiblit le système immunitaire, les personnes porteuses sont plus à même de contracter d’autres maladies opportunistes comme la paludisme ou la tuberculose.
Appui technique pour aider les populations vulnérables touchées par la Leishmaniose viscérale
Epicentre participe au groupe de travail sur les maladies tropicales négligées de Médecins Sans Frontières (MSF) et lui apporte conseils et expertises. La recherche comporte des études qualitatives et quantitatives et ce, en raison de son expertise et de ses études dans le domaine.
Ethiopie : atteindre les travailleurs mobiles

L'incidence estimée de la leishmaniose viscérale symptomatique en Éthiopie est d’environ 4000 cas par an avec une possible sous-déclaration.2 Des obstacles demeurent toutefois aussi pour établir un diagnostic que pour accéder aux soins pour la leishmaniose viscérale, particulièrement pour les 250 000 travailleurs qui se déplacent annuellement vers la région nord-ouest du pays pour effectuer des travaux agricoles3. Epicentre, en collaboration avec ses partenaires, a mené une étude qualitative pour comprendre la nature de ces obstacles et pour définir des stratégies qui permettront d’accroître l'accès des travailleurs mobiles à ces services.
En 2017, dans le district de Kafta Humera, au Tigré en Éthiopie, 50 entretiens approfondis et 11 discussions de groupe ont été conduits avec des travailleurs mobiles, des patients atteints de leishmaniose viscérale, des soignants et des dirigeants communautaires. Les participants ont fait état d'une grande vulnérabilité à la leishmaniose viscérale chez les travailleurs mobiles et les résidents occupant des emplois intermittents. Parmi les obstacles importants au diagnostic et aux soins, on peut noter la formation inadéquate du personnel de santé, l'indisponibilité des kits de diagnostic dans les structures de soins de santé primaires, l’absence de sensibilisation à la leishmaniose viscérale , le manque de financement favorisant l’accès aux soins et la priorité donnée aux activités génératrices de revenus reléguant le traitement de la leishmaniose viscérale au second plan.

Les politiques sociales et le déblocage de fonds affectés à la leishmaniose viscérale influencent fortement et positivement la prise en charge . Les travailleurs qui ne sont pas en mesure de recevoir des avances sur salaire, d’indemnisation compensatrice pour travailler à temps partiel ou d'aide de leurs pairs sont particulièrement désavantagés. Les participants ont suggéré l’intervention des autorités dans les domaines suivants : assurer l'accès des travailleurs mobiles aux moustiquaires, à de la nourriture, à un abri, à de l'eau potable et aux soins de santé qu’ils soient aux champs ou en congé maladie ; permettre la décentralisation des tests de diagnostic au profit des établissements de soins primaires ; renforcer les stocks de médicaments et le personnel pendant la haute saison ; préparer le système de santé à mieux orienter les patients, prendre en compte l’expérience passée, notifier les cas et assurer la formation du personnel ; offrir la gratuité de services de santé à toutes les personnes atteintes de leishmaniose viscérale et assurer l’éducation à la santé dans les communautés.
Au final, cette étude donne des orientations pour les interventions en urgence en fonction des besoins socio-économiques et sanitaires des travailleurs mobiles (et des autres personnes atteintes de leishmaniose viscérale) afin de réduire les disparités en matière de santé et diminuer le poids que représente la leishmaniose viscérale en matière de santé publique.
Soudan : comprendre la prévention
Bien que la leishmaniose viscérale ait fait l'objet d'études approfondies en Asie 4,5, il existe peu de données sur les facteurs de risque individuels de transmission au Soudan. Epicentre et ses partenaires ont donc mené en 2012-2013 une étude cas-témoin afin d'identifier les déterminants individuels et domestiques de la leishmaniose viscérale primaire dans 24 villages fortement endémiques de l'État de Gedaref, au Soudan. Les enfants et les hommes apparaissent comme les plus à risque. Quant à la survenue d’un ou plusieurs cas de LV dans le foyer au cours de l'année précédente, cela semble être le facteur de risque le plus important.
Cette analyse multivariée a aussi montré que une augmentation du risque associé avec d’autres critères : l'endroit où l'on dort (à l'extérieur, dans la cour), la taille du ménage, les activités extérieures en soirée pendant la saison des pluies, l'utilisation d'huile d'arachide et de fumée de mimosa épineux (Acacia seyal) comme insectifuges, la présence de chiens dans la cour le soir et la proximité de forêts de gommiers rouges (Acacia nilotica). Le risque semble décroître si on consomme de l’eau ne provenant du réservoir du village, quand une zone tampon sépare les cours entre les maisons adjacentes et et lorsque que d’autres animaux que des chiens sont présent dans la cour la nuit.
Ouganda et Kenya : cartographie des variations régionales de la leishmaniose
En Ouganda et au Kenya, Epicentre a effectué une analyse rétrospective des données cliniques recueillies régulièrement dans un hôpital soutenu par MSF. L'étude n'a révélé aucune fluctuation saisonnière ou annuelle marquée de la LV, les adolescents de 5-14 ans étant les plus touchés. L'évaluation d'un test rapide à base d'antigène rK39 comme diagnostic de première ligne a révélé qu'il était comparable au test d'agglutination directe et à la biopsie de la rate, bien que sa faible sensibilité reste un problème. Le traitement de première intention au stibogluconate de sodium a entraîné de faibles taux de létalité et peu de rechutes.
Il est important de noter que cette étude a révélé que les caractéristiques épidémiologiques et cliniques de la LV à la frontière entre l'Ouganda et le Kenya étaient très différentes de celles du Soudan, ce qui suggère la nécessité d’études spécifiques dans des régions différentes à cause des caractéristiques du parasite qui semble évoluer géographiquement.
LeichAcess, un consortium pour accélérer la lutte contre la leichmaniose viscérale et son élimination
Epicentre est membre du consortium LeichAcess. Il s’agit d’un projet de trois ans qui vise à améliorer l'accès aux soins pour les patients atteints de leishmaniose, y compris les groupes vulnérables, pour les différentes formes de la maladie (leishmaniose viscérale, leishmaniose cutanée, PKDL et VL/HIV). Il est mis en œuvre par un consortium composé d'experts et d'institutions de santé clés et se déroule en Éthiopie, au Kenya, au Sud-Soudan, au Soudan et en Ouganda. Parmi les objectifs de LeishAccess figurent l’accès aux diagnostics et aux combinaisons de traitements optimaux pour traiter la leishmaniose viscérale, la co-infection LV/VIH et la leishmaniose cutanée post-kala-azar. Le projet améliorera également l'accès au traitement des cas de leishmaniose cutanée non compliquée par thermothérapie locale et mènera des recherches opérationnelles pour améliorer l'accès au diagnostic et au traitement de la LV. Il doit contribuer à la réalisation des objectifs de la feuille de route de l'Organisation mondiale de la santé sur les maladies tropicales négligées en ce qui concerne la lutte contre la leishmaniose viscérale et son élimination.
Ressources sélectionnées
Difficultés d’accès au diagnostic et au traitement de la leishmaniose viscérale chez les travailleurs saisonniers et les agriculteurs dans le Tigray, Ethiopie - Coulborn R - Video 2017 (EN)
Difficultés d’accès au diagnostic et au traitement de la leishmaniose viscérale chez les travailleurs saisonniers et les agriculteurs dans le Tigray, Ethiopie - Coulborn R - Abstract 2017 (EN)
Publications sélectionnées
Determinants of Visceral Leishmaniasis: A Case-Control Study in Gedaref State, Sudan.
Barriers to access to visceral leishmaniasis diagnosis and care among seasonal mobile workers in Western Tigray, Northern Ethiopia: A qualitative study.
Clinical epidemiology, diagnosis and treatment of visceral leishmaniasis in the Pokot endemic area of Uganda and Kenya.
Diagnostic accuracy of two rK39 antigen-based dipsticks and the formol gel test for rapid diagnosis of visceral leishmaniasis in northeastern Uganda.
Treatment options for visceral leishmaniasis: a systematic review of clinical studies done in India, 1980-2004.
Références
1 https://www.who.int/fr/news-room/fact-sheets/detail/leishmaniasis
2 Eco-epidemiology of visceral leishmaniasis in Ethiopia Endalamaw Gadisa, Teshome Tsegaw, Adugna Abera, Dia-Eldin Elnaiem, Margriet den Boer, Abraham Aseffa, Alvar Jorge Parasit Vectors . 2015 Jul 19;8:381. doi: 10.1186/s13071-015-0987-y.
3 Tsegaw T, Gadisa E, Seid A, Abera A, Teshome A, Mulugeta A, Herrero M, Argaw D, Jorge A, Aseffa A (2013) Identification of environmental parameters and risk mapping of visceral leishmaniasis in Ethiopia by using geographical information systems and a statistical approach. Geospat Health 7: 299-308.
4 Bush JT, Wasunna M, Alves F, Alvar J, Olliaro PL, Otieno M, Sibley CH, Strub WN, Guerin PJ (2017) Systematic review of clinical trials assessing the therapeutic efficacy of visceral leishmaniasis treatments: A first step to assess the feasibility of establishing an individual patient data sharing platform. PLoS Negl Trop Dis 11: e0005781.
5 WHO (2010) Control of the Leishmaniases: Report of a meeting of the WHO Expert Committee on the Control of Leishmaniases, Geneva, 22-26 March 2010.